
Lägg till som läxa
Lägg till som stjärnmärkt
Frågor hjälpmarkerade!
Alla markeringar försvinner.
KURSER /
Fysik 1
/ Kärnfysik
Isotoper och Nuklidkartan
Innehåll
Isotoper och Nuklidkartan
I tidigare lektioner har vi konstaterat att antalet protoner i en atomkärna (som kallas för atomens atomnummer) bestämmer vilket grundämne som atomen är.
T.ex. så har en väteatom en proton medan en heliumatom innehåller två protoner samt en litium atom innehåller tre protoner, osv.
När man för ned de olika grundämnena i det periodiska systemet så skriver man de oftast i form av rutor på följande form:
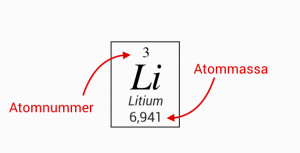
I denna ruta så representerar den övre siffran atomnumret, dvs antalet protoner.
Medan det nedre talet motsvarar atommassan som anges i enheten u.
Lägg märke till att man inte på något ställe skriver ut antalet neutroner.
Anledningen till detta är att litium atomer kan innehålla olika många neutroner.
Det finns helt enkelt olika typer av litium atomer som skiljs åt av deras neutron antal.
De olika varianterna av litium kallas för Litium-isotoper. Det är nämligen så att:
Isotoper
Atomer med samma antal protoner men olika antal neutroner kallas för isotoper.
Isotoper är olika atomvarianter av samma grundämne.
Hur många isotoper som finns för varje grundämne varierar.
I fallet med Litium så kan atomkärnan innehålla 1 till 8 st neutroner.
Detta innebär att det finns totalt 8 st olika isotoper av litium.
Men endast två av dessa är stabila, medan de andra atomkärnorna sönderfaller blir till ett nytt grundämne.
Det periodiska systemet ger alltså endast en överblick över vilka atomtyper som finns med avseende på antal protoner.
Men om man också vill se vilka isotoper som finns av varje grundämne så behövs det en större tabell.
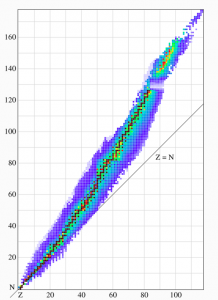
Det vanligaste sättet att måla upp samtliga typer av atomkärnor är i en s.k. nuklidkarta.
Kommentarer
██████████████████████████
████████████████████████████████████████████████████
e-uppgifter (3)
-
1. Premium
Vad kallas atomer som har samma antal protoner men olika antal neutroner?
Bedömningsanvisningar/Manuell rättningRätta själv Klicka i rutorna och bedöm ditt svar.-
-
Rättad
-
+1
-
Rättad
Rättar... -
2. Premium
Vilket av följande påståenden stämmer inte?
Bedömningsanvisningar/Manuell rättningRätta själv Klicka i rutorna och bedöm ditt svar.-
-
Rättad
-
+1
-
Rättad
Rättar... -
3. Premium
Avgör vad som stämmer om en atomkärna med $56$ neutroner samt $46$ protoner.
Bedömningsanvisningar/Manuell rättningRätta själv Klicka i rutorna och bedöm ditt svar.-
-
Rättad
-
+1
-
Rättad
Rättar...

Endast Premium-användare kan kommentera.